Анализ на щелочность воды. Определение щелочности и кислотности воды
Читайте также
Одним из показателей качества воды, позволяющих судить о химических и биологических процессах протекающих в ней, является значение рН. В природных водах, являющихся сложными растворами, концентрация ионов водорода зависит не только от диссоциации и гидролиза молекул воды, диссоциации и гидролиза солей, но и от содержания диоксида углерода и его производных, содержания гумусовых кислот и др.
Основной системой, регулирующей содержание ионов водорода в природных водоемах, является так называемая карбонатная система. Углекислый газ, растворяясь в воде, частично превращается в угольную кислоту, способную диссоциировать по уравнению:
Н 2 СО 3 ÛНСО 3 - +Н +
где К 1 – первая константа диссоциации, равна 4 . 10 -7 .
Существенное влияние на содержание ионов водорода оказывает имеющиеся в воде гидрокарбонаты Са(НСО 3) и Мg(НСО 3) 2 , которые в результате диссоциация увеличивают содержание в воде ионов НСО 3 - и уменьшают содержание Н + .
Ионы НСО 3 - также диссоциируют с образованием протонов:
НСО 3 - Н + + СО 3 2-
Условиям равновесия обычно отвечают следующие переходы:
СО 2 + Н 2 О Н + + НСО 3 - 2Н + + СО 3 2-
Из уравнения видно, что различное значение рН воды указывает на различное содержание в воде различных составляющих данного уравнения.
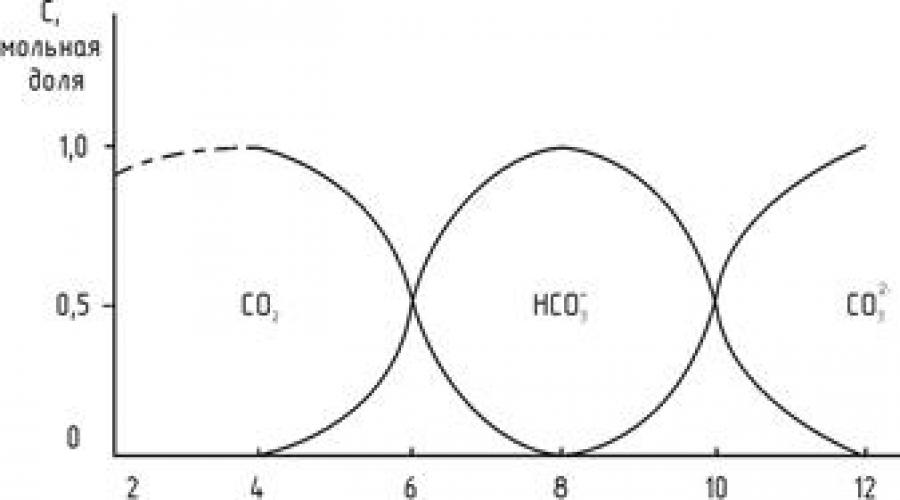
При нормальных условиях рН природных вод близко к значению 8,5. При этом значении распространен гидрокарбонатион НСО 3 - . В этой форме углерод легко усваивается водными организмами. Содержание ионов водорода в природных водах может меняться в довольно широких пределах (рН = 4...9). Количественное соотношение между различными соединениями углекислоты определяется уравнениями диссоциации I и II ступени, которые зависят от концентрации ионов водорода, поэтому существование различных форм углекислоты в растворе определяется рН. При рН до 3,7-4,0 вся находящаяся в воде углекислота представлена только диоксидом углерода. По мере повышения рН доля СО 2 уменьшается, а следовательно, возрастает доля гидрокарбонатов – НСО 3 - . При рН = 8,3-8,4 практически вся углекислота находится в виде гидрокарбонта (98%), а на долю СО 2 + СО 3 2- приходится менее 2%. При дальнейшем повышении рН свободного СО 2 в воде нет, а только НСО 3 - и СО 3 2- . При рН = 12 в растворе находятся только карбонаты. Зависимость содержания различных соединений углерода от рН приведена на рис. 2.

Защелачивание водоемов свидетельствует об интенсивном процессе фотосинтеза. Закисление говорит о наличии гумусовых кислот. Изменение рН может быть вызвано гидролизом солей тяжелых металлов, поступлением кислых или щелочных стоков и другими причинами.
Карбонатная система обладает буферными свойствами и способна поддерживать определенное значение рН и нейтрализовать поступление кислыхили щелочных стоков. К основным характеристикам природных вод относят их кислотность и щелочность. Под кислотностью понимают содержание в воде веществ, способных вступить в реакцию с сильными щелочами. К этим веществам можно отнести:
а) сильные кислоты, полностью диссоциирующие в воде;
б) слабые кислоты (уксусная, сернистая, угольная и др.);
в) катионы слабых оснований (ионы аммония, железа, органических оснований и др.).
Соединения, содержащие эти катионы, гидролизуются с образованием ионов водорода. При аналитическом определении кислотности вода различают общую и свободную кислотность. Свободная кислотность – это кислотность, которую обнаруживают при титровании щелочью до рН = 4,5.
Общая кислотность определяется суммарным количеством щелочи (мг-экв/л), пошедшей на титрование до щелочной среды (до рН ~ 8,3), Полагают, что в этом случае будут нейтрализованы все вещества, обусловливающие кислотность.
Щелочность воды обусловлена наличием растворимых оснований, средними и кислыми солями, обычно гидрокарбонатами щелочных и щелочноземельных металлов. Определяется щелочность воды титрованием сильными кислотами. Различают свободную и общую щелочность.
Если рН воды > 8,3, то количество кислоты (мг-экв/л) необходимое для снижения рН до 8,3, будет характеризовать свободную щелочность.
При дальнейшем титровании до рН =4,5 определяют суммарное количество кислоты, которое характеризует общую щелочность воды.
Цель работы: научиться определять рН воды, кислотность и щелочность природных вод различными методами, анализировать причины, влияющие на данные свойства вод.
Оборудование и реактивы: иономер универсальный ЭВ-74; стеклянный и хлорсеребряный электроды; фенолфталеин, 1%-ный спиртовой раствор; метиловый оранжевый, 1%-ный спиртовой раствор; едкий натр (или калий), 0,1 н. раствор; серная кислота, 0,1 н. раствор.
Сущность метода заключается в титровании пробы стандартным раствором кислоты в присутствии индикаторов фенолфталеина или метилового оранжевого.
Чувствительность метода 50 мкг-экв./дм 3 .
Диапазон определяемых значений - от 0,5 до 20 мг-экв./л.
Комплектация рассчитана на проведение 1000 определений.
Необходимые для проведения анализа приборы и материалы:
Посуда:
Колбы мерные 2-1000-2 по ГОСТ 1770.
Колбы Кн-250 ТХС по ГОСТ 25336Е.
Цилиндры мерные вместимостью 100 см 3 по ГОСТ 1770
Воронка коническая стеклянная по ГОСТ 23932.
Бюретка 1-2-25-0,1 по ГОСТ 29251.
Реактивы:
Вода дистиллированная по ГОСТ 6709 (вода обессоленная, конденсат).
Состав набора:
Кислота соляная, стандарт-титр для приготовления раствора с концентрацией 0,1 г-экв./дм 3 .
Метиловый оранжевый, индикатор, 0,1% водный раствор по ГОСТ 4919.1.
Фенолфталеин, индикатор, сухая смесь, по ГОСТ 4919.1.
Реактивы, входящие в состав набора, проверяются на соответствие требованиям действующих стандартов и технических условий.
Поправочные коэффициенты на нормальность стандартных растворов находятся в пределах 1±0,003.
Приготовление рабочих растворов.
Перед проведением анализа необходимо приготовить раствор соляной кислоты.
Для приготовления раствора соляной кислоты необходимо количественно перенести содержимое ампулы в мерную колбу, растворить примерно в 800-900 мл дистиллированной воды, хорошо перемешать и довести объем раствора до метки дистиллированной водой.
Время, затрачиваемое на проведение операции - около 20 минут.
Поправочный коэффициент для растворов, приготовленных из стандарт-титров, равен единице.
Готовый раствор перелить в емкости для хранения.
Проведение анализа.
1. В чистую коническую колбу Кн 2-250 мерным цилиндром отмеряют 100 см 3 анализируемой воды и прибавляют индикатор фенолфталеин.
Если проба имеет розовую окраску, ее титруют стандартным раствором соляной кислоты до обесцвечивания раствора. Результат титрования заносят в журнал. После чего к пробе прибавляют 3-4 капли раствора индикатора метилового оранжевого. Проба окрасится в желтый цвет.
Если после прибавления к пробе фенолфталеина окрашивание не проявляется. К пробе следует сразу прибавить 3-4 капли раствора индикатора метилового оранжевого. Проба окрасится в желтый цвет.
2. Окрашенную в желтый цвет пробу титруют стандартным раствором соляной кислоты до перехода окраски в апельсиновую.
3. Величина щелочности определяется по формулам:
Щфф=(a*C*1000)/V, где
Щ фф
- щелочность пробы по фенолфталеину, мг-экв./дм 3 ;
а фф
- расход кислоты на титрование с индикатором фенолфталеином, см 3
Щмо=(a*C*1000)/V, где
Щ мо
- щелочность пробы по метиловому оранжевому (общая щелочность), мг-экв./дм 3 ;
а мо
- расход кислоты на титрование с индикатором метиловым оранжевым (в случае последовательного титрования за объем кислоты, пошедший на титрования с метиловым оранжевым берется суммарный расход кислоты с начала титрования), см 3 ;
С - концентрация применяемого для титрования раствора соляной кислоты, г-экв./дм 3 (С=0,1 или 0,01);
V - объем взятой на титрование пробы, см 3 .
Щелочностью называется содержание в воде веществ, вступающих в реакцию с сильными кислотами. К этим веществам относятся:
– сильные основания;
– слабые основания: аммиак, анилин, пиридин и т.п.;
– анионы слабых кислот: , анионы гуминовых кислот.
Различают три формы щелочности: свободную, карбонатную и общую.
Свободная щелочность обусловлена гидроксильными и карбонатными ионами. Ее определяют количеством кислоты, идущей на титрование воды до pH 8,3.
Карбонатная щелочность зависит от наличия в воде только ионов угольной кислоты, т.е. карбонатных и гидрокарбонатных ионов, и определяется количеством кислоты, идущей на титрование воды до pH ≈ 4.
Общая щелочность обусловлена присутствием в воде анионов слабых кислот органического и неорганического происхождения, а также гидроксильных ионов.
В пресных незагрязненных водах карбонатная щелочность настолько велика по сравнению со щелочностью, вносимой другими анионами, что ее можно принимать равной общей щелочности.
Основным источником карбонатных и гидрокарбонатных ионов в поверхностных водах являются процессы химического выветривания и растворения карбонатных пород типа известняков, доломитов. Например,
СаСО 3 + Н 2 О + СО 2 ↔ Са 2+ + 2;
МgCO 3 + Н 2 О + СО 2 ↔ Mg 2+ + 2.
Некоторая часть гидрокарбонатных ионов появляется в результате метаморфизации продуктов химического выветривания изверженных пород:
CO 2 → + SiO 2 ;
OH – + CO 2 → .
Значительные количества гидрокарбонатных ионов поступают с атмосферными осадками и грунтовыми водами.
Гидрокарбонатные и карбонатные ионы выносятся в водоемы со сточными водами предприятий химической, силикатной, содовой промышленности и т.д.
По мере накопления гидрокарбонатных и особенно карбонатных ионов последние, образуя малорастворимые соединения с ионами кальция, могут выпадать в осадок:
Са(НСО 3) 2 → СаСО 3 ↓ + Н 2 О + СО 2 ;
Са 2+ + = СаСО 3 ↓.
Этот процесс имеет очень важное значение в природе, поскольку от него зависит образование толщ карбонатных пород.
В поверхностных водах гидрокарбонатные и карбонатные ионы присутствуют главным образом в растворенном состоянии. Некоторая часть карбонатных ионов может находиться во взвешенном состоянии и близком к коллоидному состоянию в виде высокодисперсных частиц карбоната кальция.
В растворе между гидрокарбонатными и карбонатными ионами существует подвижное равновесие, определяемое константами диссоциации, характеризующими первую и вторую ступень диссоциации угольной кислоты
Н 2 СО 3 ↔ Н + + ↔ Н + + .
В речных водах содержание гидрокарбонатных ионов колеблется от 30 до 400 мг/дм 3 , в озерах – от 1 до 500 мг/дм 3 . Концентрация их в морских водах колеблется в более узких пределах от 100 до 200 мг/дм 3 , в атмосферных осадках она составляет 30 – 100 мг/дм 3 , в грунтовых водах − от 150 до 300 мг/дм 3 . В подземных водах их содержание заметно возрастает от 150 до 900 мг/дм 3 .
Щелочность является важной характеристикой поверхностных вод, по которой можно судить о важнейших гидрохимических и геохимических процессах, таких как формирование химического состава вод, эрозия земной поверхности, образование карбонатных пород и т.д.
В технике величина щелочности весьма существенна, поскольку от нее зависит коррозия бетона и выпадение карбонатной накипи в котлах, питающих различные паросиловые установки.
Для определения щелочности вод используют следующие методы: прямого титрования, обратного титрования и потенциометрические.
Методы прямого титрования основаны на титровании пробы воды сильной кислотой (НСl, H 2 SO 4) в присутствии различных индикаторов, имеющих переход окраски в точке эквивалентности в области рН от 3 до 4. К ним относятся метиловый оранжевый, бромфеноловый синий, метиловый желтый. Недостатком этого наиболее простого и быстрого метода являются неопределенность значения рН в конечной точке титрования. Для определения свободной щелочности обычно используют фенолфталеин, имеющий интервал перехода рН и окраски индикатора 8,2 – 10,0.
Более точны методы обратного титрования, которые основаны на прибавлении к пробе воды избытка сильной кислоты и его титриметрическом определении в присутствии индикатора. Эти методы находят наибольшее распространение, однако при анализе вод с низкой величиной щелочности (менее 10 мг/дм 3 ), а также окрашенных и мутных вод, возможны значительные погрешности, составляющие до 20 %.
В этих случаях предпочтительны различные варианты потенциометрических методов, в которых пробу исследуемой воды титруют сильной кислотой до определенного значения рН, определяемого с помощью рН-метра. На результаты не оказывают влияние следы активного хлора, мутность и окраска воды.